7_0 pentagonale bipiramide
joodheptafluoride
In een molecule wordt een jodiumatoom 53I (2-8-18-18-7) omgeven door zeven fluoratomen 9F (2-7).
De O-schil van jodium wordt opgevuld tot veertien elektronen en de L-schil van fluor tot acht elektronen (octetconfiguratie).
Lewisstructuur
De zeven valentie-elektronen van het jodiumatoom vormen elk een gemeenschappelijk elektronenpaar met een fluorelektron. De Lewisstructuur van joodheptafluoride ziet er uit als volgt:
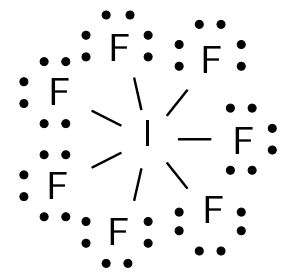
ruimtelijke structuur
De zeven fluoratomen en het jodiumatoom vormen een bipiramide (twee met hun grondvlak tegen elkaar geplaatste piramides) met het jodiumatoom als zwaartepunt.
We een kunnen een molecule joodheptafluoride ook voorstellen als volgt: