3.1 trigonale piramide
ammoniak
In een molecule ammoniak wordt een stikstofatoom omgeven door drie waterstofatomen.
De K-schil van waterstof wordt opgevuld tot twee elektronen (duetconfiguratie) en de L-schil van stikstof tot acht elektronen (octetconfiguratie).
Lewisstructuur
Drie van de vijf valentie-elektronen van het stikstofatoom vormen een gemeenschappelijk elektronenpaar met een waterstofelektron. Een vrij elektronenpaar blijft over en is niet betrokken bij de binding.
De Lewisstructuur van ammoniak ziet er uit als volgt:
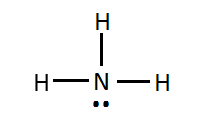
Ruimtelijke voorstelling
De drie waterstofatomen en het stikstofatoom vormen geen vlakke driehoek. Het vrije elektronenpaar van het stikstofatoom speelt speelt geen rol bij de binding, maar wel bij de vorm van een molecuul. Ook dit vrije elektronenpaar zorgt voor afstoting in de molecule. Hierdoor vormen de vier atomen een driehoekige piramide.
We kunnen ammoniak ook voorstellen als volgt: