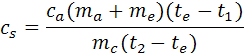Misura del calore specifico
Con i rispettivi cursori scegliere:
- Il materiale e la massa del campione di metallo che poniamo nel beaker. (Il campione deve essere ricoperto da una sufficiente quantità d'acqua.)
- La quantità d'acqua posta nel calorimetro e la sua temperatura iniziale.
- Cliccare su "reset" per inizializzare la simulazione.
- Spostare il cursore "Fornello" su "acceso"
- Aspettare che l'acqua bolla
- Spostare il campione dal beaker nel calorimetro (poi si può spegnere il fornello)
- L'acqua del calorimetro comincia a scaldarsi fino a raggiungere una temperatura di equilibrio te