Rutherford-szórás
A Rutherford-féle szórási kísérletben meghatározták, milyen mértékben térülnek el
az alfa-részecskék az arany fólián, és egy adott irányba a részecskék hányad
része jut el. Az eltérülés mértékét egy szöggel, az úgynevezett szórási szöggel
jellemezték, amely a részecske eredeti haladási irányának és az eltérülés utáni
haladási iránynak, vagyis az észlelési iránynak a szöge. (Az alfa-részecske egy
hiperbola pályán halad, a hiperbola száraihoz tartozó érintők által bezárt szög
szintén a szórási szög.) A részecskék számát a ZnS-lemezen fellépő
fényfelvillanások számából határozták meg, amit egy mikroszkóp segítségével
vizsgáltak.
Végezd el te is a kísérletet! A mikroszkóp mozgatásával változtathatod az észlelés
irányát, és így a szórási szöget. A mikroszkóp képén láthatod, hogyan változik a
szóródott részecskék száma a szög változásával.
1. feladat
Nézz utána, milyen tudományos eredmények fűződnek Rutherford nevéhez!
2. feladat
Hogyan képzelte el az atomot a Rutherford-féle atommodell? Mihez hasonlít ez a modell?
3. feladat
A Rutherford-atommodellt megelőzően milyen modelleket alkottak az atomról?
4. feladat
A Rutherford-kísérletben miért mikron vastagságú aranyfóliát, úgynevezett aranyfüstöt használtak céltárgynak?
5. feladat
Mit tudsz az atommag összetételéről?
6. feladat
Hogyan módosult volna a szórási kísérlet, ha alfa-részecskék helyett elektronokkal végezték volna el?
7. feladat
Közelítőleg milyen vastagságú aranyfólián nem jutna át egyetlen alfa-részecske sem, ha feltesszük, hogy a sugárzás irányából nézve az atommagok részben sem fedik egymást? Az aranyatommag sugara 0,8 · 10–14 m, az arany sűrűsége 19,3 kg/dm3.
Történeti háttér
- 1911-ben az atomról már tudták, hogy semleges és található benne elektron, ami negatív töltésű részecske. Az atomnak tehát kell lennie egy pozitív töltésű részének is. Az első feltételezések szerint az atom pozitív töltésű része egy folytonos anyag, amely az atom teljes térfogatát kitölti, ebben a „masszában” találhatók az elektronok. Ezt az atommodellt Joseph John Thomson angol fizikus – az elektron felfedezője – alkotta meg 1902-ben, amit szemléletesen pudingmodellnek nevezték el.
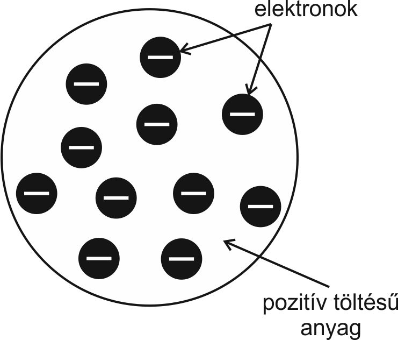 Ez az atommodell azonban Lénárd Fülöp elektronszórási kísérletét követően megdőlt.
Ez az atommodell azonban Lénárd Fülöp elektronszórási kísérletét követően megdőlt.- Lénárd elektronokkal bombázott vékony alumíniumfóliát, és azt tapasztalta, hogy elektronok szinte teljes számban átjutottak a fólián. Ez viszont csak úgy lehetséges, ha az atom belül üreges. A pozitív töltés így nem helyezkedhet el atomi méretű anyagként az atomban, hanem nagyon kis helyre kell koncentrálódnia. Ernest Rutherford angol fizikus és munkatársai 1911-ben végezték el azt a kísérletet, amelyben aranyfóliát bombáztak alfa-részecskékkel. A berendezést légritkított térbe helyezték, hogy a gázmolekulák ne zavarják az alfa-részecskék mozgását. A részecskék irányváltozását ZnS-tal bevont lemezzel követték, ebben a becsapódó részecskék hatására fényvillanások alakulnak ki. A ZnS-os lemezt egy gömbfelület mentén mozgatták az aranylemez körül, így tudták vizsgálni az eltérülés mértékét, és – a felvillanások száma alapján – az adott irányba eltérült részecskék számát. A mérési eredmények szerint az alfa-részecskék nagy része irányváltozás nélkül haladt át az aranyfólián, sokaknak változott a pályaalakja, és akadt olyan is, kb. minden százezredik részecske, amelyik „visszapattant” a fóliáról. Ez a kísérlet bebizonyította, hogy az atom üreges szerkezetű, benne a pozitív töltés nagyon kisméretű térrészben összpontosul, miközben nagyon nagy tömeggel rendelkezik. Ez a pozitív centrum az atommag, amelynek sugara számítások szerint kb. százezred része az atom sugarának.