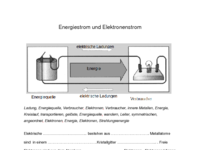
2. 1 Von der Reibungselektrizität zum elektrischen Strom
- Autor:
- R. Kanevski
In unserem heutigen Leben kämen wir ohne Elektrizität niemals aus. Sei es für das Musik hören, sich gegenseitig Nachrichten am Handy schreiben oder Computerspiele zu spielen. Um all dies zu ermöglichen brauchen alle Geräte elektrische Energie, oder umgangssprachlich Strom.
Bloß was hat elektrische Energie mit dem elekrischen Strom zutun? Das wirst du im Folgenden erfahren.
In den letzen Kapiteln hast du gelernt, dass alle Stoffe aus Atom bestehen. Atome hat man früher für die kleinsten Teilchen der Materie gehalten. Inzwischen weiß man, dass ein Atom aus einem Atomkern (Protone und Neutrone) und einer Atomhülle (Elektronen) besteht. Die Elektronen, die sich nah am Atomkern bewegen, sind stark an den Atomkern gebunden. Die Elektronen, die sich an der außeren Bahn bewegen, sind schwach an den Atomkern gebunden und lassen sich durch die Reibung, aber auch z. B. durch chemische Vorgänge aus den Atomen raußreißen. Diese Elektronen werden freie Elektronen genannt.
Die Trennung von Ladunge erfolgt z. B. in einer Batterie.
![Quelle: Quelle: [url=https://www.elektronik-kompendium.de/sites/grd/0110271.htm]https://www.elektronik-kompendium.de/sites/grd/0110271.htm[/url], eigene Bearbeitung](https://www.geogebra.org/resource/kvchgqaq/nTiEkCsers57Vz75/material-kvchgqaq.png)
Aufbau und Funktion einer Batterie

Das Prinzip der Batterie
Batterien und Akkus funktionieren nach dem Prinzip der sogenannten „Galvanischen Zelle“. Dabei sausen kleine elektrisch negativ geladene Teilchen (Elektronen) in einem Kreislauf umher und erzeugen Strom. Dadurch beginnt deine Taschenlampe zu leuchten oder dein Handy spielt deine Lieblingsmusik. Wie im Bild unten dargestellt, findet man in einer „Galvanischen Zelle“ zwei miteinander verbundene Gefäße mit verschiedenen Flüssigkeiten und Metallen.
Eine Batterie besteht aus einer oder mehreren galvanischen Zellen.
Dieses Bild stellt Vorgänge in einer Batterie dar.
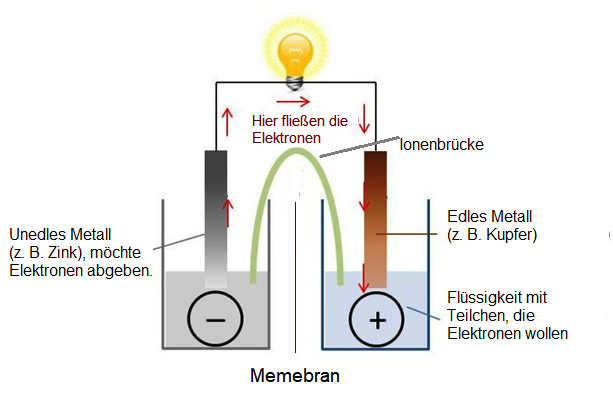
Metalle und ihre Vorlieben
Metalle haben die Eigenschaft, dass sie kleine, elektrisch negativ geladene Teilchen (Elektronen) abgeben können. Manche Metalle geben diese Teilchen gerne ab, andere möchten sie lieber behalten. Darum sagt man auch, dass Metalle „unterschiedlich edel“ sind. Gold, Silber und Kupfer sind edle Metalle. Das heißt, sie möchten so bleiben wie sie sind und ihre Elektronen lieber bei sich behalten. Die nicht so edlen Metalle, wie zum Beispiel Zink, geben ihre Elektronen viel lieber ab. Diese Eigenschaften werden bei einer Batterie ausgenutzt.
Warum die Teilchen im Kreise wandern
Im Bild oben (Galvanische Zelle) sind die zwei Gefäße mit den zwei verschiedenen Metallen dargestellt. Bei einer Batterie entsprechen diese Gefäße dem Minus- und Plus-Pol.
Das unedle Metall (Zink) befindet sich im linken Gefäß in einer Flüssigkeit. Es wird „glücklicher“, wenn es die Elektronen abgeben kann.
Im rechten Gefäß findest du das edle Metall (Kupfer) , das in diesem Zustand total zufrieden ist. Allerdings gibt es in dieser Flüssigkeit andere Teilchen, die unbedingt Elektronen erhalten möchten, um so zu werden, wie das edle Metall. Diese Flüssigkeit zieht die Elektronen an.
Wenn du nun die Taschenlampe einschaltest, gibt das unedle Metall im linken Gefäß die Elektronen ab. Die Teilchen in der Flüssigkeit im rechten Gefäß nehmen diese Elektronen sehr gerne auf.
So entsteht ein Elektronenfluss vom linken Gefäß ins rechte. Dabei sausen die Elektronen an der Glühbirne vorbei und bringen sie zum Leuchten. Die „Ionenbrücke“ wird als Verbindung zwischen den beiden Gefäßen benötigt, damit der Kreislauf nicht unterbrochen ist.
In einer Animation du die Funktion einer galvanischen Zelle genauer betrachten. Schließe den Schalter!
Zusammenfassung. Übertrage in dein Heft!
Der Zinkstab, auch Zinkelektrode genannt, ist also der Minuspol einer Batterie. Er hat einen
Elektronenüberschuß (zu viele Elektronen). Der Kupferstab (Kupferelektrode) ist der Pluspol der Batterie. Es hat ein Elektronenmangel (zu wenige Elektronen). Schließt man den Stromkreis, wandern die Elektronen durch den Kabel (Leiter) von dem Minus- zum Pluspol der Batterie.
Elektrische Ladungen haben die Eigenschaft, sich auszugleichen: Plus und Minus ergeben „Neutral“. Wenn irgendwo die Ladungen getrennt vorliegen, dann muss das jemand oder etwas durch zugefügte Energie geschafft haben. Diese zugefügte Energie liegt dann gespeichert als elektrische Energie in der „Getrenntheit“ der Ladungen in einer Batterie vor.
Daher bezeichnet man eine Batterie als Energiequelle. Im Alltag wird sie auch Stromquelle genannt.
Vertiefung
Im Chemieunterricht wirst du dein Wissen über die Funktion einer galvanischen Zelle vertiefen.
Elektrischer Strom
In diesem Video wird erklärt, was elektrischer Strom genau ist.
Was ist elektrischer Strom?
Lückentext. Wenn du nicht ausdrucken kannst, dann zeichne das Bild und schreibe den Text ab.
WERDE AKTIV 1: Bearbeite das AB und reiche im Aufgabenmodul ein.
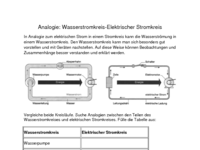
Analogie: Wasserstromkreis-elektrischer Stromkreis
In Analogie zum elektrischen Strom in einem Stromkreis kann die Wasserströmung in einem
Wasserstromkreis. Den Wasserstromkreis kann man sich besonders gut vorstellen und mit
Geräten nachstellen. Auf diese Weise können Beobachtungen und Zusammenhänge besser verstanden
und erklärt werden.
Analogie: Wasserstromkreis - elektrischer Stromkreis
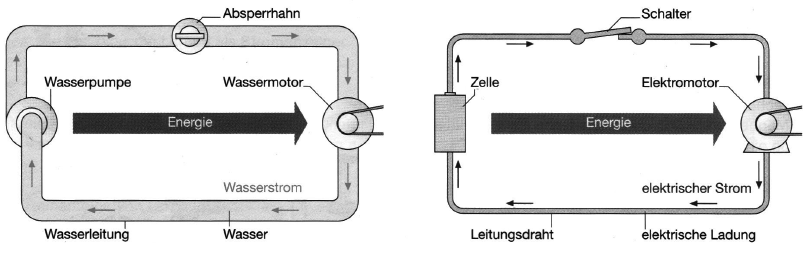
Analogie-Wasserstromkreis-elektrischer Stromkreis. Wenn du nicht ausdrucken kannst, zeiche die Tabelle ab und fülle sie aus.
Zusammenfassung. Übertrage in dein Heft!
Der elektrische Strom durch metallische Leiter ist eine gerichtete Bewegung von Elektronen (Elektronenstrom) vom Minuspol zum Pluspol. Im elektrischen Stromkreis wird Energie von der Quelle zum Gerät transportiert. Der elektrische Strom ist ein Energieträger.
Frage
Warum ist die Alltagsbezeichnung „Verbraucher“ für ein Elektrogerät eigentlich falsch?