van Democritos tot Bohr
geschiedenis
Reeds in de Griekse Oudheid werd nagedacht over de structuur van de materie. Democritos formuleerde een eerste atoommodel. In de loop van de geschiedenis werd dit model meerdere keren bijgesteld. We geven een kort overzicht van Democritos tot Sommerfeld.
Democritos (460-370 v.C.)
"Je kunt voorwerpen niet oneindig in stukken snijden. Op een bepaald ogenblik bekom je een deeltje dat je niet meer kan verdelen."
Deze minuscule, ondeelbare deeltjes noemt Democritos 'atomen'.
John Dalton (1766-1844)
Stoffen zijn opgebouwd uit ondeelbare en massieve atomen.
In een chemische reactie verenigen atomen zich tot verbindingen in constante verhoudingen.
Joseph John Thomson (1856-1940)
Atomen zijn massief, maar niet ondeelbaar. Ze zijn opbebouwd uit veel kleinere, negatief geladen electronen, ingebed in een positief geladen massa. Het atoom in zijn geheel is elektrisch neutraal.
Ernest Rutherford (1871-1937)
Atomen zijn niet massief maar ijl. Ze bestaan uit een harde, positieve kern, met daarrond een wolk van bewegende elektronen.
Niels Bohr (1885-1962)
Elektronen bewegen niet willekeurig rond de kern, maar op een beperkt aantal welbepaalde energieniveau's (schillen).
- Een atoom bezit 7 mogelijke energieniveaus of schillen concentrisch rond de kern. Elektronen die zich op dezelfde schil bewegen bezitten eenzelfde energie-inhoud.
- Deze schillen dragen een schilnummer van 1 tot en met 7 . Ze worden ook aangeduid met de letters K, L, M, N, O, P, Q (beginnend vanaf de kern).
- Op schil met nummer n is er plaats voor maximaal 2n² elektronen, met een maximum van 32. Het maximum aantal elektronen per schil is dus: schil K: 2 elektronen schil L: 8 elektronen schil M: 8 elektronen schillen N, O, P en Q: 32 elektronen
- De elektronen bevinden zich bij voorkeur zo dicht mogelijk bij de kern. Ze bevinden zich dan in de energetisch laagste toestand. Schillen het dichtst bij de kern worden dus het eerst opgevuld met elektronen. Pas als deze vol zijn worden hoger gelegen schillen opgevuld.
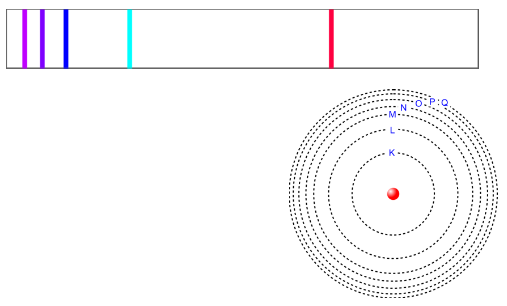
Uit spectrumonderzoek blijkt dat het licht dat atomen uitzenden niet verdeeld is over een continu spectrum, maar een lijnenspectrum vormt van welbepaalde kleuren. Bohr leidde hieruit af dat de elektronen zich op welbepaalde energieniveau's moesten bevinden. Ruimtelijk komt dit neer op schillen op welbepaalde afstanden van de kern.